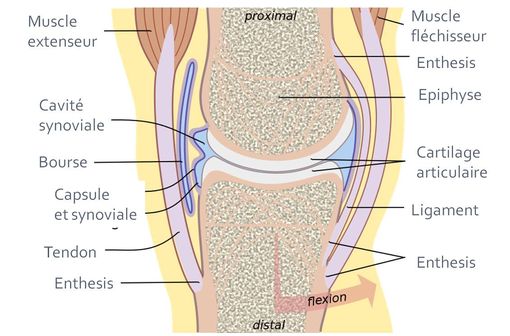
Articulation synoviale type (illustration @Madhero88, sur Wikimedia).
HUMIRA solution injectable (adalimumab) est désormais remboursable et agréé aux collectivités lorsqu'il est indiqué dans le traitement de l'arthrite active liée à l'enthésite chez les patients à partir de 6 ans en cas de réponse insuffisante ou d'intolérance au traitement conventionnel (AINS, infiltrations intra-articulaires de corticoïdes, méthotrexate et sulfasalazine).
Les trois présentations d'HUMIRA sont concernées par cette extension de prise en charge :
- HUMIRA 40 mg solution injectable sous-cutanée (SC) en seringue préremplie ;
- HUMIRA 40 mg solution injectable SC en stylo prérempli ;
- HUMIRA 40 mg/0,8 ml solution injectable SC pour usage pédiatrique.
A propos de l'arthrite associée aux enthésopathies
L'arthrite liée à l'enthésite est une arthrite juvénile idiopathique (AJI), dont elle représente 10 à 20 % des cas, et qui constitue la forme pédiatrique de la spondylarthrite de l'adulte.
Elle se traduit cliniquement par une arthrite, une atteinte des enthèses (zones d'insertion osseuse, des ligaments, des tendons et des capsules) et une uvéite antérieure aiguë. Elle débute habituellement vers l'âge de 10 à 12 ans et touche les garçons dans 70 % des cas.
Selon C. Job Deslandre (Orphanet, mise à jour 2007), la prévalence l'arthrite liée à l'enthésite est comprise entre 1,5 et 45 enfants pour 100 000, avec une incidence annuelle de 0,05 à 3/100 000 enfants.
Dans son avis du 1er avril 2015, la Commission de la transparence estimait, à partir d'un ensemble de données épidémiologiques, que la "population cible d'HUMIRA dans l'arthrite associée aux enthésopathies chez les enfants âgés de 6 à 17 ans serait au maximum de 54 enfants".
A ce jour, HUMIRA et ENBREL (étanercept) sont les seuls médicaments de la classe des anti-TNF disposant en France d'une autorisation de mise sur le marché (AMM) dans cette indication, dès l'âge de 6 ans pour HUMIRA et à partir de 12 ans pour ENBREL.
Un nombre d'articulations actives touchées statistiquement moindre avec l'adalimumab
La Commission de la transparence a évalué la tolérance et l'efficacité d'HUMIRA sur la base d'une étude (M11-328, non publiée) multicentrique, randomisée en double aveugle versus placebo chez 46 patients pédiatriques (âgés de 6 à 17 ans), naïfs de biothérapie, présentant une arthrite liée à l'enthésite modérée (avis du 1er avril 2015). Débutée en juillet 2012, cette étude est toujours en cours.
La comparaison avec ENBREL, le comparateur cliniquement pertinent d'HUMIRA dans cette indication à partir de l'âge de 12 ans, n'était pas réalisable du fait que l'étanercept ne dispose de cette autorisation de mise sur le marché (AMM) que depuis juillet 2012.
L'atteinte active d'au moins 3 articulations et une réponse inadéquate ou une intolérance à au moins un AINS et à au moins un traitement de fond (sulfasalazine ou méthotrexate) faisait partie des critères d'inclusion de l'étude.
Les patients ont été randomisés pour recevoir, toutes les deux semaines pendant 12 semaines, soit une dose d'HUMIRA de 24 mg/m² de surface corporelle jusqu'à une dose maximale de 40 mg (n = 31), soit un placebo (n = 15).
La phase en double aveugle a été suivie d'une phase en ouvert durant laquelle les patients recevaient une dose d'HUMIRA de 24 mg/m² de surface corporelle jusqu'à une dose maximale de 40 mg toutes les deux semaines par voie sous-cutanée pendant 192 semaines supplémentaires.
Le critère d'évaluation principal était la variation en pourcentage du nombre d'articulations actives touchées par l'arthrite (gonflement non lié à une malformation ou articulations avec perte de mouvement et douleur et/ou sensibilité) entre l'inclusion et la semaine 12.
Les critères secondaires ont été analysés selon un ordre hiérarchique prédéfini à la semaine 12 : nombre d'enthésites (0-35), nombre d'articulations douloureuses (0-72), nombre d'articulations gonflées (0-68), proportion de patients répondeurs ACR pédiatrique 30, 50, 70.
Pour rappel, le score ACR (American College of Rheumatology) pédiatrique est un score composite pour évaluer la réponse aux traitements des AJI avec atteinte polyarticulaire (voir Tableau I).
| Les AJI poly articulaires ou d'évolution poly articulaire, 6 items suivants : |
|
|
Critères de réponse proposés pour la forme systémique d'AJI :
|
A la semaine 12, la supériorité de l'adalimumab par rapport au placebo a été démontrée dans l'analyse principale en intention de traiter (ITT) : une réduction moyenne de - 62,6 % (variation médiane : - 88,9 %) en pourcentage du nombre d'articulations inflammatoires a été observée chez les patients traités par HUMIRA par rapport à - 11,6 % (variation médiane : - 50,0 %) chez les patients recevant le placebo (p = 0,039).
L'amélioration relative au nombre d'articulations actives touchées par l'arthrite a été maintenue au cours de la phase en ouvert jusqu'à la semaine 52 de l'étude.
Cette étude n'a en revanche démontré aucune différence statistique entre HUMIRA et le placebo sur l'ensemble des critères secondaires évalués, incluant des critères cliniques pertinents (enthésite, réponse ACR pédiatrique).
En termes de tolérance, les résultats, certes limités, n'ont mis en évidence aucun événement indésirable pouvant être spécifique à l'arthrite associée aux enthésopathies.
Les événements indésirables les plus fréquents ont été les infections (29 % pour l'adalimumab versus 20 % pour le placebo).
Trois patients ont arrêté le traitement au cours de la phase ouverte pour EI.
Des données à long terme sont nécessaires.
Un traitement de fond de seconde intention dans l'arthrite active liée à l'enthésite
Dans son avis du 1er avril 2015, la Commission de la transparence a jugé le service médical rendu (SMR) d'HUMIRA important dans le traitement de l'arthrite active associée aux enthésopathies.
En termes de stratégie thérapeutique relative à l'arthrite active liée à l'enthésite, HUMIRA doit être utilisé en traitement de fond de seconde intention, après échec du traitement conventionnel comportant les AINS, les infiltrations de corticoïdes et les traitements de fond classiques (méthotrexate ou sulfasalazine).
En pratique
Dans le traitement de l'arthrite liée à l'enthésite, la posologie recommandée d'HUMIRA pour les patients à partir de 6 ans est de 24 mg/m² de surface corporelle jusqu'à une dose unique maximale de 40 mg d'adalimumab toutes les deux semaines en injection sous-cutanée.
Le volume d'injection est déterminé en fonction de la taille et du poids du patient.
Un tableau de correspondance entre la posologie d'HUMIRA en mL, la taille et le poids du patient est présenté dans la Monographie VIDAL - Rubrique posologie et mode d'administration.
HUMIRA n'a pas été étudié chez les patients de moins de 6 ans atteints d'arthrite liée à l'enthésite.
Pour mémoire
Le taux de remboursement d'HUMIRA est de 65 %.
HUMIRA est soumis à prescription initiale hospitalière annuelle.
La seringue préremplie et le stylo prérempli doivent être prescrits par un spécialiste en rhumatologie, en gastroentérologie, en chirurgie digestive, en dermatologie, en pédiatrie ou en médecine interne.
La prescription de la forme pédiatrique est réservée aux spécialistes en rhumatologie, en pédiatrie, en médecine interne, en gastroentérologie ou en chirurgie digestive.
Médicament d'exception, la prescription d'HUMIRA doit être en conformité avec la fiche d'information thérapeutique.
La seringue préremplie et le stylo prérempli d'HUMIRA sont indiqués dans le traitement de (Voir détail des indications dans la monographie VIDAL - Rubrique Indications) :
- la polyarthrite rhumatoïde ;
- la spondylarthrite axiale ;
- le rhumatisme psoriasique ;
- le psoriasis ;
- la maladie de Crohn ;
- la rectocolite hémorragique.
- l'arthrite juvénile idiopathique, dont l'arthrite juvénile idiopathique polyarticulaire et l'arthrite liée à l'enthésite ;
- le psoriasis en plaques de l'enfant et de l'adolescent ;
- la maladie de Crohn chez l'enfant et l'adolescent.
Pour aller plus loin
Arrêté du 31 juillet 2015 modifiant la liste des spécialités pharmaceutiques remboursables - Fiche d'information thérapeutique d'HUMIRA (Journal officiel, 28 août 2015)
Arrêté du 31 juillet 2015 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités (Journal officiel, 28 août 2015)
Avis de la Commission de la Transparence (HAS, 1er avril 2015)
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.