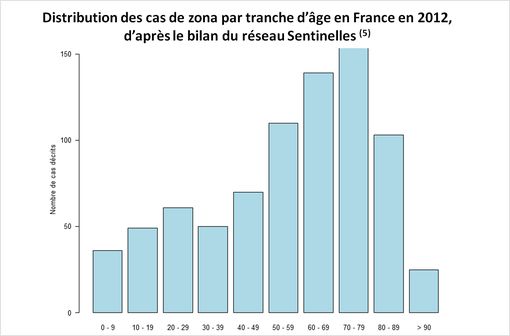
Selon les études, les DPZ s’observent dans 12 à 28 % des cas au-delà de 90 jours (extrait de l'avis de la Commission de la transparence du 15 octobre 2014).
ZOSTAVAX poudre et solvant pour suspension injectable sous cutanée (SC) est un nouveau vaccin vivant atténué, indiqué pour la prévention du zona et des douleurs post-zostériennes (DPZ).
ZOSTAVAX est indiqué pour la vaccination des sujets de 50 ans et plus.
En 2013, le HCSP (Haut Conseil de la Santé Publique) a recommandé cette vaccination chez les adultes âgés de 65 à 74 ans révolus avec un schéma vaccinal à une dose.
Durant la première année suivant l'inscription du vaccin au calendrier vaccinal, les personnes âgées de 75 à 79 ans révolus pourront être vaccinées dans le cadre d'un rattrapage.
Le calendrier vaccinal 2015 ne mentionne pas encore la vaccination contre le zona.
ZOSTAVAX : quelle efficacité clinique?
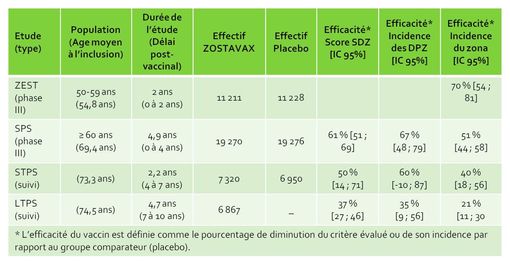
Les données d'efficacité disponibles pour le vaccin ZOSTAVAX reposent sur 2 études de phase III, ZEST (ZOSTAVAX Efficacy and safety trial)(1) et SPS (Shingles prevention study)(2) et sur 2 études de suivi, STPS (Short-term persistence substudy)(3) et LTPS (Long-term persistence substudy)(4), dont les résultats d'efficacité sont résumées dans le tableau 1 ci-dessous.
Tableau 1 : Synthèse des résultats d'efficacité des études SPS, STPS, LTPS et ZEST
Dans son avis du 15 octobre 2014, la Commission de la transparence a considéré que le service médical rendu par ZOSTAVAX est modéré "dans la prévention du zona et des douleurs post-zostériennes, dans les populations recommandées par le Haut Conseil de la Santé Publique dans son avis du 25 octobre 2013, compte tenu de :
- l'efficacité modeste sur l'incidence du zona dans les populations recommandées par le Haut Conseil de la Santé Publique,
- la diminution de la protection vaccinale avec l'âge et au cours du temps,
- la contre-indication de la vaccination en cas d'immunodépression."
Le profil de tolérance de ZOSTAVAX a par ailleurs semblé globalement satisfaisant malgré une fréquence importante de réactions locales, les plus fréquemment rapportées dans les différentes études ayant été transitoires, à type d'érythème, de douleurs ou de gonflement (35,8 %, 34,5 % et 26,2 % respectivement dans l'étude SPS).
Des réactions systémiques, considérées comme possiblement liées au vaccin, ont par ailleurs été signalées dans 6,3 % des cas lors de l'étude SPS, principalement à type de céphalées.
Remboursement pour une population restreinte
La prise en charge de ZOSTAVAX par l'Assurance maladie a été accordée au taux de 30 % pour les personnes âgées de 65 à 74 ans révolus selon un schéma à une dose et, jusqu'au 28 février 2017, pour les personnes âgées de 75 à 79 ans révolus (correspondant à un rattrapage).
L'indication pour le remboursement est plus restreinte que celle octroyée par l'autorisation de mise sur le marché (AMM), qui autorise l'utilisation de ZOSTAVAX à partir de 50 ans. La décision de la Commission de la Transparence concernant la prise en charge de ZOSTAVAX suit les recommandations du HCSP (Haut Conseil de Santé publique) émises en 2013.
Un schéma à une dose
ZOSTAVAX est un vaccin vivant atténué contenant la souche OKA/MERCK du virus de la varicelle et du zona.
Le schéma vaccinal recommandé comporte une dose administrée par voie sous-cutanée, de préférence dans la région deltoïdienne.
La nécessité d'une seconde dose n'est actuellement pas connue.
ZOSTAVAX peut être administré en même temps que le vaccin grippal inactivé en 2 injections distinctes réalisées en des sites différents.
Cette vaccination est contre-indiquée chez les sujets immunodéprimés (cancer, VIH) ou en cas de traitement immunosuppresseur.
La présence de trace de néomycine doit être prise en compte lors de la prescription.
En pratique : un vaccin réfrigéré à reconstituer
ZOSTAVAX nécessite une conservation au réfrigérateur, entre 2 °C et 8 °C.
Avant l'injection, la suspension injectable doit être reconstituée à partir de la poudre du flacon et du solvant contenu dans la seringue préremplie.
Après reconstitution, ZOSTAVAX doit être utilisé immédiatement.
Données épidémiologiques sur le zona
Les principaux facteurs de risque de zona sont l'âge (phénomène d'immunosénescence), les maladies pouvant induire un déficit immunitaire (VIH, cancer) et les traitements corticoïdes et immunosuppresseurs.
D'autres facteurs de risque sont également rapportés (sexe féminin, événements stressants, hérédité, etc.).
En France, environ 2/3 des cas de zona surviennent après 50 ans, et la moitié chez des patients de 60 ans et plus avec une incidence de 5 à 10 cas pour 1 000 habitants.
En 2012, l'incidence du zona après 65 ans a été estimée à 130 000 cas.
Identité administrative
- Liste I
- Flacon de poudre + seringue préremplie de solvant avec 2 aiguilles séparées, CIP 3400937593007
- Remboursable à 30 % dans la prévention du zona et des douleurs post-zostériennes des personnes âgées de 65 à 74 ans révolus selon un schéma à une dose
- Prix public TTC = 127,24 euros
- Agrément aux collectivités dans la prévention du zona et des douleurs post-zostériennes des personnes âgées de 65 à 74 ans révolus selon un schéma à une dose
- Pour les personnes âgées de 75 à 79 ans révolus, la prise en charge (remboursement et agrément aux collectivités) est assuré jusqu'au 28 février 2017
- Laboratoire Sanofi Pasteur MSD SNC
Pour aller plus loin :
Se reporter à la monographie VIDAL de ZOSTAVAX (mise à jour du 12 juin 2015)
Arrêté du 5 juin 2015 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux (Journal officiel, 10 juin 2015)
Arrêté du 5 juin 2015 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel, 10 juin 2015)
Avis de la Commission de la Transparence (HAS, 15 octobre 2014)
Vaccination des adultes contre le zona avec le vaccin Zostavax - Avis du 25 octobre 2013 (HCSP)
Résumé EPAR pour le public (EMA, mise à jour du 5 février 2015)
Etudes citées dans l'article :
(1) Schmader KE, Myron JL, Gnannjr JW, et al. Efficacy, Safety, and Tolerability of Herpes Zoster Vaccine in Persons Aged 50 – 59 Years. Clin Infect Dis. 2012 Apr;54(7):922-8. Epub 2012 Jan 30.
(2) Oxman MN, Levin MJ, Johnson GR, et al. A Vaccine to Prevent Herpes Zoster and Postherpetic Neuralgia in older Adults. N Engl J Med 2005;352:2271-84.
(3) Schmader KE, Oxman MN, Levin MJ, et al. Persistence of the Efficacy of Zoster Vaccine in the Shingles Prevention Study and theShort-Term Persistence Substudy. Clinical Infectious Diseases Advance Access published July 24, 2012.
(4) Les références de l'étude LTPS (Long-term persistence substudy) ne sont pas précisées dans l'avis de la Commission de transparence relatif à ZOSTAVAX (HAS, 15 octobre 2014)
(5) Réseau Sentinelles. Bilan annuel 2012
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.