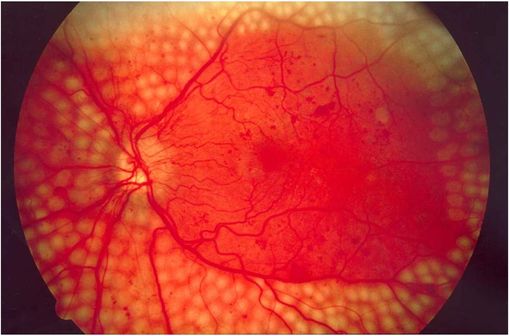
Points de coagulation laser dans le traitement de la rétinopathie diabétique (illustration @National Eye Institute, National Institutes of Health sur Wikimedia).
BYDUREON 2 mg poudre et solvant pour suspension injectable à libération prolongée (exénatide) est un nouvel antidiabétique injectable indiqué dans le traitement du diabète de type 2 en association :
- à la metformine,
- aux sulfamides hypoglycémiants,
- aux thiazolidinediones(*),
- à la metformine et un sulfamide hypoglycémiant,
- à la metformine et une thiazolidinedione(*),
(*) Les spécialités à base de thiazolinedione ne sont plus commercialisées en France depuis 2011.
Le principe actif de BYDUREON est l'exénatide, un agoniste du récepteur du glucagon-like peptide-1 (GLP-1), qui :
- stimule la sécrétion d'insuline de façon glucose-dépendante,
- inhibe la sécrétion du glucagon,
- ralentit la vidange gastrique,
- et diminue le taux d'absorption intestinal du glucose.
Pour mémoire, cette substance est déjà disponible en France et prise en charge dans la spécialité BYETTA 5 µg et 10 µg, solution injectable en stylo prérempli, dont le rythme d'injection est biquotidien.
Dans son avis du 22 octobre 2014, la Commission de la transparence soulignait "l'intérêt de l'administration de BYDUREON 2 mg en une injection hebdomadaire."
Place de BYDUREON dans la stratégie thérapeutique
La Commission de la transparence a précisé la place de BYDUREON dans la stratégie de prise en charge du diabète de type 2 de la manière suivante :
"Selon les recommandations de prise en charge du diabète de type 2, l'instauration d'un analogue du GLP-1, incluant l'exénatide (principe actif de BYDUREON) est recommandée :
- en bithérapie (en association avec la metformine ou un sulfamide hypoglycémiant) et en trithérapie (en association avec la metformine et un sulfamide hypoglycémiant)
- dans les situations particulières où :
- l'écart à l'objectif est supérieur à 1% d'HbA1c,
- l'IMC >= 30 kg/m²
- ou si la prise de poids sous insuline ou la survenue d'hypoglycémies sont préoccupants."
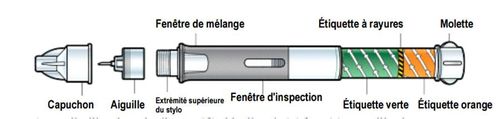
Un stylo à 2 chambres
BYDUREON est présenté en stylo prérempli unidose à deux chambres contenant respectivement la poudre et le solvant.
Le stylo est muni d'une molette, d'une étiquette verte, d'une étiquette à rayures, d'une étiquette orange, et de deux fenêtres de contrôle.
Figure 1 : Stylo prérempli unidose de BYDUREON (extrait du Manuel d'utilisation de BYDUREON)
La suspension est reconstituée en tournant la molette du stylo conformément aux instructions (Manuel d'utilisation, Cf. page 90 du résumé des caractéristiques du produit).
Après la reconstitution, il est recommandé d'inspecter la suspension obtenue à travers les deux côtés de la fenêtre de mélange : elle ne doit contenir aucune particule et doit être uniformément trouble.
Figure 2 : Visualisation de la solution reconstituée dans la fenêtre de mélange
du stylo prérempli de BYDUREON (extrait du Manuel d'utilisation de BYDUREON)
du stylo prérempli de BYDUREON (extrait du Manuel d'utilisation de BYDUREON)

En pratique
La dose recommandée de BYDUREON est de 2 mg d'exénatide 1 fois par semaine.
BYDUREON doit être administré le même jour chaque semaine, à n'importe quel moment de la journée, avec ou sans repas.
Le jour de l'administration hebdomadaire peut être modifié si nécessaire à condition que la dose suivante soit administrée au moins un jour (24 heures) plus tard.
Chaque dose doit être administrée par injection sous-cutanée dans l'abdomen, la cuisse, ou l'arrière du bras, immédiatement après la mise en suspension de la poudre dans le solvant.
Quand BYDUREON est associé :
- à un traitement par metformine et/ou une thiazolidinedione, le traitement par metformine et/ou une thiazolidinedione peut être poursuivi à la même posologie ;
- à un traitement par un sulfamide hypoglycémiant, une diminution de la posologie du sulfamide hypoglycémiant doit être envisagée afin de diminuer le risque d'hypoglycémie.
Auto-injection : une formation préalable est recommandée
BYDUREON est à administrer par le patient lui-même.
Chaque stylo doit être utilisé par une personne uniquement et une seule fois.
Avant l'initiation de BYDUREON, il est fortement recommandé que les patients reçoivent un apprentissage par un professionnel de santé. Un « Manuel d'utilisation » est fourni à l'intérieur de chaque boîte afin d'accompagner le patient.
Conseil aux patients
BYDUREON est à conserver au réfrigérateur entre 2 °C et 8 °C (ne pas congeler) dans l'emballage extérieur d'origine afin de le protéger de la lumière.
Les stylos peuvent être gardés jusqu'à 4 semaines à une température ne dépassant pas 30 °C avant utilisation.
La manipulation de BYDUREON doit être faite avec des mains propres.
Avant la reconstitution de la suspension, il est recommandé d'inspecter le liquide à travers la fenêtre d'inspection : le liquide (solvant) doit être limpide et sans particule.
Avant l'injection, il est recommandé de laisser le stylo se réchauffer pendant 15 minutes après avoir mélangé la poudre avec le solvant et s'être assuré que la solution obtenue est uniformément trouble (voir figure 2).
L'utilisation de BYDUREON ne nécessite pas d'autosurveillance supplémentaire. L'autosurveillance glycémique peut être nécessaire afin d'ajuster la dose des sulfamides hypoglycémiants.
Si le patient oublie de prendre une dose, celle-ci doit être administrée dès que possible.
Le patient ne doit pas injecter plus d'une dose dans une période de 24 heures.
Si le patient n'est pas sûr d'avoir injecté toute la dose, il ne doit pas injecter une autre dose de BYDUREON.
Les patients doivent être informés des symptômes caractéristiques des pancréatites aiguës : douleur abdominale sévère et persistante. Si une pancréatite est suspectée, BYDUREON doit être arrêté.
Identité administrative
- Liste I
- Boîte de 4 stylos unidoses avec aiguilles et aiguilles de rechange, CIP 3400928012012
- Remboursable à 65 % dans le traitement du diabète de type 2, en association à la metformine et/ou un sulfamide hypoglycémiant (Journal officiel du 12 mai 2015)
- Prix public TTC = 91,02 euros
- Agrément aux collectivités dans le traitement du diabète de type 2, en association à la metformine et/ou un sulfamide hypoglycémiant (Journal officiel du 12 mai 2015)
- Laboratoire AstraZeneca
Pour aller plus loin
Se reporter à la monographie VIDAL de BYDUREON (mise à jour du 20 mai 2015)
Manuel d'utilisation (RCP de BYDUREON, page 90)
Avis de la Commission de la Transparence (HAS, 3 décembre 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.