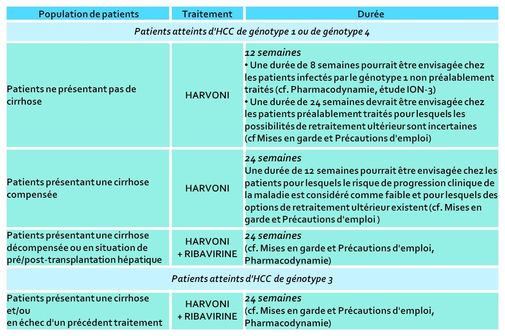
HARVONI, durée recommandée du traitement.
HARVONI est indiqué dans le traitement de l'hépatite C chronique (HCC) chez les adultes.
Association fixe de deux antiviraux à action directe, HARVONI se compose de :
- lédipasvir (90 mg par comprimé), un nouveau principe actif inhibiteur du virus de l'hépatite C (VHC) ciblant la protéine NS5A du VHC, qui est essentielle pour la réplication de l'ARN et l'assemblage des virions du VHC ;
- sofosbuvir (400 mg par comprimé), un inhibiteur pan-génotypique de l'ARN polymérase ARN-dépendante NS5B du VHC, qui est essentielle pour la réplication du virus.
HARVONI fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
ATUc et AMM : des périmètres non superposables
HARVONI a été disponible sous autorisation temporaire d'utilisation (ATU) de cohorte jusqu'au 18 décembre 2014 dans le traitement de patients adultes atteints d'infection virale C chronique et :
- présentant une maladie à un stade avancé (avec fibrose hépatique F3/F4 ou présentant des manifestations extra-hépatiques du VHC),
- ou étant sur liste d'attente pour une transplantation hépatique,
- ou ayant subi une transplantation hépatique et présentant un récurrence de l'infection par le virus de l'hépatite C,
- ou ayant subi une transplantation rénale.
A ce titre, HARVONI n'est pas pris en charge pour les patients adultes ayant une hépatite C chronique (HCC) due au virus de génotype 1, 3 ou 4 :
- avec une maladie à un stade moins avancé (avec fibrose hépatique <= F2 et ne présentant pas des manifestations extra-hépatiques du VHC)
- et n'ayant pas subi une transplantation hépatique,
- et n'ayant pas subi une transplantation rénale.
Modalités posologiques et population cible
Le traitement par HARVONI doit être initié et surveillé par un médecin expérimenté dans la prise en charge des patients atteints d'HCC.
La dose recommandée est de 1 comprimé d'HARVONI 1 fois par jour, avec ou sans nourriture.
Des données de posologie sont fournies pour une utilisation chez des patients atteints d'HCC de génotype 1, 3 et 4, sans ou avec une cirrhose compensée ou décompensée (Cf. monographie VIDAL et illustration en haut de cet article).
La durée de traitement varie selon la population de patients (12 semaines ou 24 semaines).
En outre, une association avec la ribavirine est recommandée :
- chez les patients atteints d'HCC de génotype 1 ou 4, présentant une cirrhose décompensée ou en situation de pré/post-transplantation hépatique,
- chez les patients atteints d'HCC de génotype 3, présentant une cirrhose et/ou en échec d'un précédent traitement.
Précautions d'emploi
HARVONI est contre-indiqué avec la rosuvastatine et le millepertuis.
La coadministration d'HARVONI et d'inhibiteurs de la HMG-CoA réductase (statines) peut augmenter significativement la concentration de la statine, ce qui accroît le risque de myopathie et de rhabdomyolyse.
En outre, les médicaments puissants inducteurs de la glycoprotéine P (P-gp), comme la rifampicine, la carbamazépine et la phénytoïne, ne doivent pas être utilisés avec HARVONI. En effet, ils peuvent diminuer significativement les concentrations plasmatiques du lédipasvir et du sofosbuvir, ce qui peut réduire l'effet thérapeutique d'HARVONI.
L'utilisation avec certains antirétroviraux contre le VIH doit être prise en compte.
Conseils aux patients
En cas de vomissements dans les 5 heures suivant la prise de leur dose, les patients doivent prendre un autre comprimé.
Si les vomissements surviennent plus de 5 heures après la prise de leur dose, il n'est pas nécessaire de prendre une autre dose.
Si les patients oublient de prendre une dose et qu'ils s'en rendent compte dans les 18 heures qui suivent leur prise habituelle, ils doivent prendre le comprimé le plus tôt possible et ensuite prendre la dose suivante comme prévu. S'ils s'en rendent compte plus de 18 heures après, ils doivent attendre et prendre la dose suivante comme prévu. Les patients doivent être informés de ne pas prendre de double dose.
Recommandations de la HAS pour l'utilisation des antiviraux d'action directe
La HAS a émis des recommandations en juin 2014 afin de préciser la stratégie thérapeutique dans l'hépatite C suite à la mise à disposition des premiers antiviraux à action directe.
Cette stratégie thérapeutique vise un objectif de guérison virologique individuelle (Cf. notre article du 2 juillet 2014).
La HAS recommande de traiter :
- tous les malades ayant une cirrhose ou une fibrose hépatique aux stades F3 et F4, en attente ou non de greffe hépatique ou en post-greffe ;
- et quel que soit le stade de fibrose :
- les patients infectés concomitamment par le VIH et le VHC ;
- les patients atteints de cryoglobulinémies mixtes (II et III) systémiques symptoma- tiques ;
- les lymphomes B associés au VHC ;
- les patients au stade F2.
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en gastro-entérologie et hépatologie, en médecine interne ou en infectiologie
- Flacon de 28 comprimés, CIP 3400927959660
- Pris en charge selon les conditions définies à l'article L.162-16-5-2 du code de la Sécurité sociale
- Non remboursable, prix libre
- Agréé aux collectivités et rétrocédable par prolongation des conditions d'inscription au titre de l'ATU de cohorte (demande d'admission à l'étude)
- Laboratoire Gilead Sciences
Pour aller plus loin
ANNEXE AVIS N° 2014.0115/SEM du 17 DECEMBRE 2014 - Identification des alternatives pour un médicament post-ATU, pré-inscription (HAS, décembre 2014)
ATU de cohorte de ledipasvir/sofosbuvir Gilead 90 mg/400 mg, comprimé pelliculé (ANSM, mise à jour du 15 janvier 2015)
Sur Vidal.fr
Hépatite C : la Reco Vidal a été actualisée, intégrant les nouveaux antiviraux à action directe (30 janvier 2015)
Hépatite C chronique et comorbidités : quelles stratégies thérapeutiques ? (28 janvier 2015)
Stratégie thérapeutique dans l'hépatite C : les recommandations de la HAS (2 juillet 2014)
La monographie en lien ci-dessous est en cours de mise à jour concernant les informations contenues dans cette article à la date de sa publication.
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.