GIOTRIF est indiqué dans la prise en charge certains cancers bronchiques non à petites cellules.
GIOTRIF comprimé pelliculé (afatinib) est désormais disponible sur le marché français.
Ce médicament est indiqué en monothérapie dans le traitement des patients adultes naïfs de TKI (inhibiteurs de la tyrolien kinase) anti-EGFR (récepteur du facteur de croissance épidermique), atteints d'un cancer bronchique non à petites cellules (CBNPC) localement avancé ou métastatique qui présente une (des) mutation(s) activatrice(s) de l'EGFR.
GIOTRIF existe sous 4 dosages : 20 mg, 30 mg, 40 mg et 50 mg.
Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
A propos de l'afatinib
L'afatinib est un inhibiteur irréversible, puissant et sélectif des récepteurs de la famille ErbB (inhibiteur de tyrosine kinase). Les protéines ErbB sont présentes à la surface des cellules cancéreuses et interviennent dans la stimulation de la division incontrôlée des cellules. En se liant de manière covalente à tous les homo- et hétérodimères formés par les membres de la famille ErbB (dont l'EGFR), l'afatinib bloque de façon irréversible les signaux provenant de ces récepteurs et ralentit la croissance et la propagation du cancer bronchique non à petites cellules.
GIOTRIF en pratique
Le traitement doit être initié et supervisé par un médecin expérimenté dans l'utilisation des traitements anticancéreux.
Le statut mutationnel de l'EGFR doit être établi avant l'initiation du traitement.
La dose recommandée est de 40 mg 1 fois par jour.
Aucune nourriture ne doit être prise au moins 3 heures avant et au moins 1 heure après la prise de ce médicament. La coadministration d'un repas riche en graisse avec GIOTRIF a conduit à une baisse significative de l'exposition à l'afatinib.
Les comprimés doivent être avalés en entier avec de l'eau. Si le patient ne peut pas avaler les comprimés entiers, ceux-ci peuvent être dispersés dans environ 100 ml d'eau plate. Aucun autre liquide ne doit être utilisé. Le comprimé doit être mis dans l'eau sans être écrasé, puis agité de temps à autre pendant 15 minutes au maximum, jusqu'à ce qu'il se soit dispersé en très petites particules. La dispersion doit être bue immédiatement. Le verre doit être rincé avec environ 100 ml d'eau, qui doivent également être bus. La dispersion peut également être administrée au moyen d'une sonde gastrique.
Adaptation de la dose
La dose quotidienne maximale est de 50 mg.
Cette posologie peut être envisagée chez les patients qui tolèrent une dose de 40 mg/jour pendant les 3 premières semaines de traitement, c'est-à-dire absence de diarrhée, d'éruption cutanée, de stomatite et d'autres effets indésirables de grade CTCAE > 1 (voir tableau 1 ci-dessous).
Tableau 1 : Grades CTCAE (Common Terminology Criteria for Adverse Events)
du NCI (National Cancer Institute)

Les effets indésirables symptomatiques (par exemple, diarrhée sévère/persistante ou effets indésirables cutanés) peuvent être pris en charge efficacement par une interruption du traitement et des réductions de dose, ou par l'arrêt total du traitement par GIOTRIF.
GIOTRIF et les autres médicaments
Il est recommandé d'administrer les puissants inhibiteurs de la P-gp (P-glycoprotéine) notamment, mais pas exclusivement, le ritonavir, la ciclosporine A, le kétoconazole, l'itraconazole, l'érythromycine, le vérapamil, la quinidine, le tacrolimus, le nelfinavir, le saquinavir et l'amiodarone, le plus à distance possible de la prise d'afatinib en respectant, de préférence, un intervalle de 6 heures ou de 12 heures par rapport à la prise de GIOTRIF.
Les puissants inducteurs de la P-gp notamment, mais pas exclusivement, la rifampicine, la carbamazépine, la phénytoïne, le phénobarbital ou le millepertuis, sont susceptibles de réduire l'exposition à l'afatinib.
A savoir et à dire aux patients
La mise en place de GIOTRIF doit être associée à des précautions d'emploi permettant de limiter les risques d'événements indésirables tels que :
- diarrhées : hydratation adéquate et médicaments antidiarrhéiques disponibles immédiatement si besoin ;
- éruptions cutanées ou l'acné : port de vêtements protecteurs et produits de protection solaire ;
- kératites : consultation d'un ophtalmologiste en cas de symptômes aigus ou s'aggravant (inflammation oculaire, larmoiement, sensibilité à la lumière, vision floue, douleur oculaire et/ou yeux rouges) et vigilance accrue chez les porteurs de lentilles ;
- affection pulmonaire interstitielle (API) : examen approfondi des patients présentant une apparition aiguë et/ou une aggravation inexpliquée de symptômes pulmonaires (dyspnée, toux, fièvre) ;
- insuffisance hépatique sévère : évaluation régulière de la fonction hépatique recommandée chez les patients présentant une maladie hépatique préexistante ;
- fonction ventriculaire gauche : envisager une surveillance cardiaque (comprenant la mesure de la fraction d'éjection ventriculaire gauche) chez les patients avec des facteurs de risque cardiaque et ceux qui présentent des pathologies susceptibles de modifier la FEVG.
GIOTRIF n'est pas recommandé chez les patients atteints d'une insuffisance rénale sévère (clairance de la créatinine < 30 ml/min), et chez les patients présentant une insuffisance hépatique sévère (score de cirrhose Child-Pugh C : voir tableau 2 ci-dessous).
Tableau 2 : Score de Child-Pugh
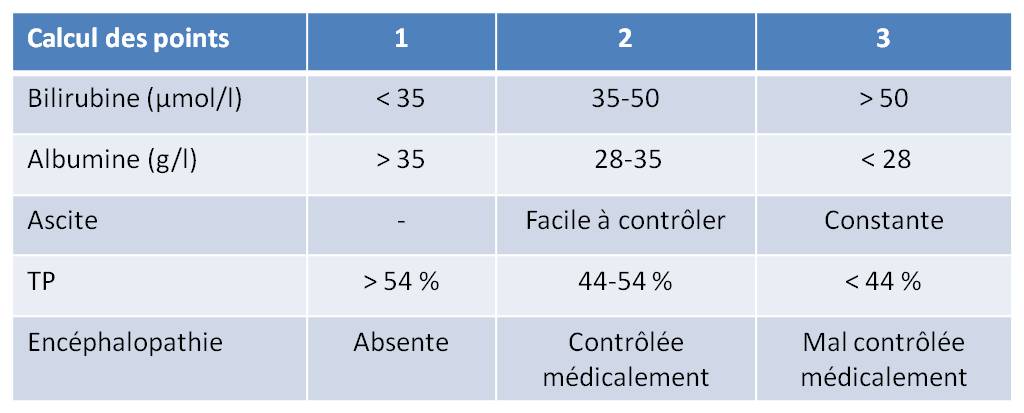
Points attribués : Classe A : 5 à 6 ; Classe B : 7 à 9 ; Classe C : 10 à 15.

Points attribués : Classe A : 5 à 6 ; Classe B : 7 à 9 ; Classe C : 10 à 15.
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- GIOTRIF 20 mg, boîte de 28, CIP 3400927565649
- GIOTRIF 30 mg, boîte de 28, CIP 3400927565700
- GIOTRIF 40 mg, boîte de 28, CIP 3400927565878
- GIOTRIF 50 mg, boîte de 28, CIP 3400927565939
- Remboursable à 100 % et agréé aux collectivités dans le traitement de première intention du cancer bronchique non à petites cellules localement avancé ou métastatique avec mutation(s) activatrice(s) de l'EGFR
- Prix public TTC = 1 983,26 euros
- Laboratoire Boehringer Ingelheim France
Pour aller plus loin
Se reporter à la monographie VIDAL de GIOTRIF
Avis de la Commission de la Transparence du 19 février 2014 (HAS, 2014)
Résumé EPAR à l'intention du public (EMA, dernière mise à jour du 16 octobre 2013)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.