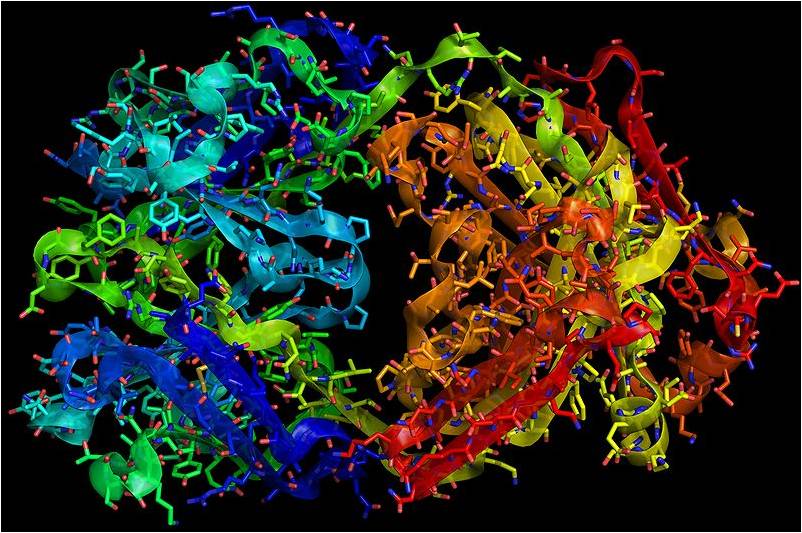
Le trastuzumab est un anticorps monoclonal recombinant (@ RedAndr, Wikimedia).
Une rupture d'approvisionnement en HERCEPTIN 150 mg poudre pour solution à diluer pour perfusion (trastuzumab) a été signalée par le laboratoire Roche.
Selon les dernières données communiquées sur le site de l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) et confirmées à VIDAL par le laboratoire, une remise à disposition prochaine est annoncée, à partir du 11 février 2014.
Des unités britanniques mises à disposition
Durant cette brève rupture, le laboratoire, en accord avec l'ANSM, met exceptionnellement à disposition des établissements français des unités d'HERCEPTIN initialement destinées au marché britannique.
Ces spécialités sont identiques, à l'exception de la notice et de l'étiquetage rédigés en anglais. La livraison de chaque unité sera par conséquent accompagnée d'une copie de la notice de HERCEPTIN en français.
Le stock d'unités importées étant limité, il doit être réservé aux seuls patients en cours de traitement ou dont le traitement doit être rapidement initié.
La constitution de stock dans les établissements de santé est ainsi temporairement exclue.
Pour mémoire
HERCEPTIN doit être conservé au réfrigérateur (ente 2°C et 8°C). Cette spécialité est destinée à être administrée par voie intraveineuse uniquement après reconstitution et dilution.
HERCEPTIN est indiqué dans les situations suivantes :
-
traitement du cancer du sein métastatique HER2 positif :
- en monothérapie, chez les patients déjà prétraités par au moins deux protocoles de chimiothérapie pour leur maladie métastatique. Les chimiothérapies précédentes doivent au moins inclure une anthracycline et un taxane, à moins que ces traitements ne conviennent pas aux patients. Les patients répondeurs à l'hormonothérapie doivent également être en échec à l'hormonothérapie, à moins que ces traitements ne leur conviennent pas ;
- en association avec le paclitaxel, chez les patients non prétraités par chimiothérapie pour leur maladie métastatique et chez lesquels le traitement par anthracyclines ne peut pas être envisagé ;
- en association avec le docétaxel, chez les patients non prétraités par chimiothérapie pour leur maladie métastatique ;
- en association à un inhibiteur de l'aromatase, chez les patientes ménopausées ayant des récepteurs hormonaux positifs, non traitées précédemment par trastuzumab ;
-
traitement du cancer du sein précoce HER2 positif :
- après chirurgie, chimiothérapie (néoadjuvante ou adjuvante) et radiothérapie (si indiquée) ;
- après une chimiothérapie adjuvante avec la doxorubicine et le cyclophosphamide, en association avec le paclitaxel ou le docétaxel ;
- en association à une chimiothérapie adjuvante associant le docétaxel et le carboplatine ;
- en association à une chimiothérapie néoadjuvante, suivie d'un traitement adjuvant avec HERCEPTIN, chez les patients ayant une maladie localement avancée (y compris inflammatoire) ou des tumeurs mesurant plus de 2 cm de diamètre ;
HERCEPTIN ne doit être utilisé que chez les patients atteints d'un cancer du sein précoce ou métastatique dont les tumeurs présentent soit une surexpression de HER2, soit une amplification du gène HER2 déterminée par une méthode précise et validée ;
- traitement de l'adénocarcinome métastatique de l'estomac ou de la jonction oesogastrique HER2 positif, en association à la capécitabine ou au 5-fluoro-uracile et au cisplatine chez les patients n'ayant pas été précédemment traité pour leur maladie métastatique.
HERCEPTIN doit être utilisé uniquement chez les patients atteints d'un cancer gastrique métastatique dont les tumeurs présentent une surexpression de HER2 définie par IHC2+ confirmé par un résultat FISH+ ou SISH+, ou par IHC3+. Des méthodes d'analyse précises et validées doivent être utilisées.
Sources et ressources complémentaires
HERCEPTIN 150 mg, poudre pour solution à diluer pour perfusion (trastuzumab) - Rupture de stock (ANSM, 6 février 2014)
Lettre du laboratoire Roche aux pharmaciens hospitaliers (sur le site de l'ANSM, 4 février 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.