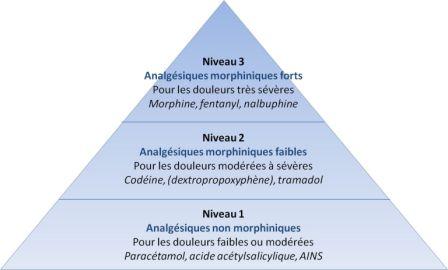
Analgésiques : les paliers de l'OMS
Le bilan du suivi de pharmacovigilance des spécialités de fentanyl transmuqueux, présenté en avril 2013 à la CSP (Commission des stupéfiants et des psychotropes) de l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) fait état de la survenue plus fréquente d'effets indésirables locaux et d'une augmentation du mésusage, en particulier une utilisation hors AMM (autorisation de mise sur le marché).
Les médicaments en question
En France, 6 spécialités de fentanyl par voie transmuqueuse (buccale ou nasale) à action rapide sont commercialisées :
En France, 6 spécialités de fentanyl par voie transmuqueuse (buccale ou nasale) à action rapide sont commercialisées :
- ABSTRAL comprimé sublingual,
- ACTIQ comprimé avec applicateur buccal,
- Edit 02/10/13 : BREAKYL film orodispersible (non commercialisé au moment de l'analyse des donnée de pharmacovigilance présentées dans cet article),
- EFFENTORA comprimé gingival,
- INSTANYL solution pour pulvérisation nasale,
- PECFENT solution pour pulvérisation nasale.
Ces spécialités appartiennent à la classe des antalgiques opioïdes de palier III et sont indiquées dans le traitement des accès douloureux paroxystiques chez des patients adultes recevant déjà un traitement de fond morphinique pour des douleurs chroniques d'origine cancéreuse.
En tant que stupéfiants, leur prescription est limitée à 28 jours et leur délivrance à 7 jours.
En tant que stupéfiants, leur prescription est limitée à 28 jours et leur délivrance à 7 jours.
Des effets indésirables locaux plus fréquents
Les données issues du suivi de pharmacovigilance de 5 de ces spécialités couvrent une période de 16 mois, d'août 2011 à décembre 2012 (Edit 02/10/13 : BREAKYL n'était pas commercialisé à cette époque).
Si tous les effets indésirables rapportés au cours de cette période sont déjà connus et mentionnés dans les RCP (résumés des caractéristiques du produit), l'analyse de ces données montre que les effets indésirables les plus fréquemment rapportés (plus fréquents que ceux observés classiquement avec les opioïdes) sont liés à la voie d'administration :
-
en cas d'administration par voie buccale :
- douleurs et irritations de la muqueuse buccale,
- ulcère,
- détérioration de l'état dentaire (caries, perte de dents partielle voire totale). Les données les plus récentes suggèrent des effets dentaires particulièrement graves pour la spécialité ACTIQ ;
-
en cas d'administration par voie nasale :
- sensation de gêne nasale,
- rhinorrhée,
- épistaxis,
- perforation de la cloison nasale.
Les effets indésirables généraux et classiquement rapportés sont :
- des effets cardiorespiratoires : dépression respiratoire, dépression circulatoire, hypotension, voire état de choc ;
- des troubles digestifs : nausées, vomissements, douleurs abdominales, constipation ;
- des troubles neurologiques : somnolence, étourdissements, perte de connaissance, convulsions.
Augmentation préoccupante du mésusage
Les données de suivi mettent également en évidence une augmentation importante et précoccupante du mésusage du fentanyl transmuqueux :
- utilisation hors AMM, c'est-à-dire pour des douleurs non cancéreuses ;
- utilisation chez des patients ayant un traitement de fond opioïde insuffisant ou inexistant ;
- prescription de doses excessives.
Des cas d'abus et de pharmacodépendance ont été rapportés, en particulier chez des patients n'ayant pas d'indication cancéreuse.
Modifier les conditions de prescription et de délivrance
Dans ce contexte, l'ANSM souligne l'importance de ne pas négliger le risque d'effets indésirables, notamment locaux, et de respecter les modalités d'utilisation précisées dans l'AMM des spécialités de fentanyl transmuqueux.
Après consultation des Sociétés savantes (d'alcoologie et d'oncologie notamment) et des laboratoires concernés,la CSP sera saisie pour proposer des modifications des conditions de prescription et de délivrance de ces spécialités afin de limiter leur mésusage.
Sources et ressources complémentaires
Pour aller plus loin
Consultez les monographies VIDAL
- ABSTRAL 100 µg cp subling
- ABSTRAL 200 µg cp subling
- ABSTRAL 300 µg cp subling
- ABSTRAL 400 µg cp subling
- ABSTRAL 600 µg cp subling
- ABSTRAL 800 µg cp subling
- ACTIQ 1200 µg cp avec applicateur buccal
- ACTIQ 1600 µg cp avec applicateur buccal
- ACTIQ 200 µg cp avec applicateur buccal
- ACTIQ 400 µg cp avec applicateur buccal
- ACTIQ 600 µg cp avec applicateur buccal
- ACTIQ 800 µg cp avec applicateur buccal
- BREAKYL 200 µg film orodispers
- BREAKYL 400 µg film orodispers
- EFFENTORA 100 µg cp buccogingiv
- EFFENTORA 200 µg cp buccogingiv
- EFFENTORA 400 µg cp buccogingiv
- EFFENTORA 600 µg cp buccogingiv
- EFFENTORA 800 µg cp buccogingiv
- INSTANYL 100 µg sol p pulv nasal en récipient unidose
- INSTANYL 100 µg/dose sol p pulv nasal multidose
- INSTANYL 200 µg sol p pulv nasal en récipient unidose
- INSTANYL 200 µg/dose sol p pulv nasal multidose
- INSTANYL 50 µg sol p pulv nasal en récipient unidose
- INSTANYL 50 µg/dose sol p pulv nasal multidose
- PECFENT 100 µg/pulvérisation sol p pulv nasal
- PECFENT 400 µg/pulvérisation sol p pulv nasal
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes 2 commentaires
2 commentaires 


Commentaires
Cliquez ici pour revenir à l'accueil.