
Le trouble dépressif concerne environ 15 à 20 % de la population générale sur une vie entière (illustration).
L'arsenal thérapeutique des épisodes dépressifs caractérisés résistants s'enrichit d'une nouvelle spécialité, SPRAVATO 28 mg solution pour pulvérisation nasale (cf. Encadré 1).
Encadré 1 - Indication thérapeutique de SPRAVATO
| SPRAVATO, en association à un ISRS* ou un IRSN**, est indiqué chez les adultes pour le traitement des épisodes dépressifs caractérisés résistants n'ayant pas répondu à au moins deux antidépresseurs différents au cours de l'épisode dépressif actuel modéré à sévère (cf. VIDAL Reco "Dépression"). |
** Inhibiteur de la recapture de la sérotonine et de la noradrénaline
Son principe actif, l'eskétamine, est un énantiomère S de la kétamine racémique. Elle agit comme antagoniste non sélectif et non compétitif des récepteurs de la N-méthyl-D-aspartate (NMDA), récepteurs ionotropiques au glutamate.
SPRAVATO est la première spécialité à base d'eskétamine disponible en France. Elle est réservée à l'usage hospitalier.
Avant d'obtenir son AMM (autorisation de mise sur le marché) et d'être commercialisée, l'eskétamine (ESKETAMINE JANSSEN 28 mg solution pour pulvérisation nasale) a été disponible en autorisation temporaire d'utilisation de cohorte (ATUc) entre le 2 août 2019 et le 25 mars 2020, dans une indication plus restreinte que celle de l'AMM actuelle (cf. Encadré 2).
Encadré 2 - Indication de l'ESKETAMINE JANSSEN - ATUc
| Traitement des épisodes dépressifs caractérisés résistants n'ayant pas répondu à au moins deux antidépresseurs différents de deux classes différentes au cours de l'épisode dépressif actuel modéré à sévère, chez des adultes présentant une contre-indication à l'électroconvulsivothérapie (ECT) ou n'ayant pas accès à l'ECT ou étant résistants à l'ECT ou ayant refusé l'ECT. Le traitement par eskétamine doit être co-administré avec un nouvel antidépresseur par voie orale. |
SPRAVATO fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
Un traitement administré par voie nasale
SPRAVATO se présente sous forme de solution pour pulvérisation nasale.
Un flacon contient 28 mg d'eskétamine. Cette dose est administrée en 2 pulvérisations, 1 dans chaque narine (cf. Infra - Description du dispositif d'administration).
D'un point de vue cinétique, la voie nasale permet une absorption rapide de l'eskétamine :
- mesure de la concentration plasmatique dans les 7 minutes suivant une dose de 28 mg ;
- concentration plasmatique maximale (Tmax) atteinte entre 20 et 40 minutes après la dernière pulvérisation nasale d'une session de traitement.
Quatre études cliniques versus placebo disponibles
Dans son avis du 24 juin 2020, la Commission de la Transparence a évalué l'efficacité et la tolérance de l'eskétamine par voie nasale sur la base notamment de quatre études cliniques de phase III, randomisées en double-aveugle versus placebo, menées dans la dépression résistante :
- TRANSFORM 1, 2 et 3, en traitement d'induction, à dose fixe ou flexible (56 mg ou 84 mg modulables ou non), chez des patients âgés de 18 à 64 ans ou, pour TRANSFORM 3, > = 65 ans ;
- SUSTAIN-1 en traitement d'entretien > ou = 48 semaines chez des patients âgés de 18 à 64 ans.
- Études TRANSFORM : une faible quantité d'effet en traitement d'induction
- étude TRANSFORM-1 (1) : évaluation de l'eskétamine intranasale à dose fixe (84 mg - âge médian 47 ans) ;
- études TRANSFORM-2 (2) et TRANSFORM-3 (3) : évaluation de l'eskétamine intranasale à dose flexible (âge médian 47 ans), et chez le sujet âgé (TRANSFORM 3 - âge médian 69 ans).
Sur ces 3 études, seule TRANSFORM-2 a démontré la supériorité du groupe eskétamine à dose flexible (56 ou 84 mg) versus placebo, sur la différence de variation du score MADRS total (cf. Encadré 3) entre l'inclusion et à 4 semaines, avec une différence entre les deux groupes de -3,5, IC95% = [-6,7 ; -0,3], punilatéral = 0,017 < au seuil de significativité pré-spécifié de 0,025).
Encadré 3 - Définition du score MADRS total
| L'échelle MADRS (Montgomery-Asberg Depression Rating Scale) est une échelle spécifique d'hétéro-évaluation de la sévérité de la dépression. Le questionnaire comporte 10 items avec comme symptômes évalués : tristesse, tension intérieure, diminution du sommeil réduit, manque d'appétit, difficultés de concentration, lassitude, incapacité à ressentir, pensées pessimistes et pensées suicidaires. Le score MADRS total varie de 0 (absence de dépression) à 60 (dépression la plus sévère) avec un seuil de 15 considéré comme une dépression et un seuil de 30 considéré comme une dépression qualifiée de sévère. |
Les résultats des études TRANSFORM-1 et TRANSFORM-3 concluent à l'absence de différence significative entre le groupe eskétamine par voie intranasale et le groupe placebo, sur la base du critère de jugement principal (variation du score MADRS total).
- Étude SUSTAIN-1 : baisse du risque de rechute
Dans cette étude, le critère de jugement principal était le délai de rechute, évalué en utilisant
le score MADRS total de manière hebdomadaire à l'aide du Guide d'entrevue structurée pour l'échelle d'évaluation de la dépression de Montgomery-Asberg (SIGMA).
La supériorité du groupe eskétamine par rapport au groupe placebo a été démontrée en termes de délai jusqu'à la rechute avec un délai médian non atteint versus 273,0 jours (HR = 0,49 ; IC95% = [0,29 ;0,84]), p = 0,003 < au seuil de significativité pré-spécifié de 0,046).
SMR faible dans une indication restreinte
Sur la base des données disponibles lors de son évaluation, la CT a attribué à SPRAVATO un SMR (service médical rendu) faible dans un périmètre d'indication plus restreint que celui de l'AMM :
- patients adultes de moins de 65 ans pour le traitement des épisodes dépressifs caractérisés résistants n'ayant pas répondu à au moins deux antidépresseurs différents de deux classes différentes au cours de l'épisode dépressif actuel sévère et en cas de contre-indication ou résistance à l'électroconvulsivothérapie ou pour les patients n'y ayant pas accès ou l'ayant refusé.
Dans les autres situations prévues par l'AMM (patients de plus de 65 ans, au cours de l'épisode dépressif actuel modéré), le SMR est considéré insuffisant en l'absence de démonstration d'efficacité versus placebo.
À noter que le laboratoire avait demandé un avis de prise en charge uniquement dans la population des patients de moins de 65 ans.
Un profil de tolérance marqué par des risques à court terme
Les études cliniques et l'utilisation en ATU (cf. Encadré 4) montrent un profil de tolérance marqué à court terme :
- par des cas de suicides/idées suicidaires ;
- par des risques importants identifiés tels que des troubles dissociatifs ou de la perception, des troubles cardiovasculaires.
Encadré 4 - Données de tolérance issues de l'utilisation en ATUc, recueillies entre le 23 septembre 2019 et le 3 janvier 2020 (30 patients)
Vingt-et-un cas rapportés correspondant à 77 effets indésirables (EI) :
La causalité entre ces EIG (idées suicidaires et tentative de suicide) et le traitement par eskétamine intranasal n'a pas été évalué par le déclarant. Pour le laboratoire, ces EIG sont possiblement liés au traitement par eskétamine. |
À noter par ailleurs les risques de survenue d'effets indésirables au cours de la période post-administration de SPRAVATO, notamment la sédation, les étourdissements et l'hypertension artérielle, nécessitant une surveillance adéquate dans la période suivant immédiatement l'administration, qui a lieu uniquement à l'hôpital.
En pratique : administration à l'hôpital et sous surveillance étroite
SPRAVATO est utilisé en auto-administration par le patient sous la surveillance directe d'un professionnel de santé. L'administration doit être réalisée à l'hôpital, afin de prendre en charge les effets indésirables pouvant survenir en période post-administration.
- Avant de prescrire SPRAVATO
- Avant d'administrer SPRAVATO : mesurer la pression artérielle et identifier les patients à risque cardiovasculaire et respiratoire
Le médicament ne doit pas être administré si une augmentation de la pression artérielle ou de la pression intracrânienne représente un risque grave.
Pour les patients atteints d'une affection cardiovasculaire ou respiratoire cliniquement significative ou instable (cf. Encadré 5), un équipement de réanimation approprié et des professionnels de santé ayant reçu une formation en réanimation cardiorespiratoire doivent être disponibles.
Encadré 5 - Affections cardiovasculaires ou respiratoires à prendre en compte en cas de traitement par SPRAVATO
|
- Administration de SPRAVATO : en 2 temps
- auto-administration par voie nasale du médicament ;
- suivie d'une période d'observation post-administration.
Après l'administration, la pression artérielle doit être réévaluée dans un délai d'environ 40 minutes, et par la suite si cliniquement nécessaire.
La sortie du patient de l'établissement peut être envisagée si le patient est cliniquement stable, sur décision d'un professionnel de santé.
- Des posologies différentes selon l'âge et l'origine ethnique
- de l'âge du patient : plus ou moins de 65 ans (cf. Tableaux I et II),
- de l'origine ethnique : recommandations spéciales pour les patients japonais.
Dans tous les cas, le schéma posologique se déroule en 2 étapes :
- 1 phase d'induction de 4 semaines,- 1 phase d'entretien.
Tableau I - Posologie recommandée pour SPRAVATO chez les adultes de moins de 65 ans
| Phase d'induction | Semaines 1 à 4 :
|
Les signes indiquant un bénéfice thérapeutique doivent être évalués à la fin de la phase d'induction, afin de déterminer la nécessité de poursuivre le traitement. |
| Phase d'entretien | Semaines 5 à 8 :
|
La nécessité de poursuivre le traitement doit être régulièrement réexaminée. |
A partir de la semaine 9 :
|
Tableau II - Posologie recommandée pour SPRAVATO chez les adultes de 65 ans et plus
| Phase d'induction | Semaines 1 à 4 :
|
Les signes indiquant un bénéfice thérapeutique doivent être évalués à la fin de la phase d'induction, afin de déterminer la nécessité de poursuivre le traitement. |
| Phase d'entretien | Semaines 5 à 8 :
|
La nécessité de poursuivre le traitement doit être régulièrement réexaminée. |
A partir de la semaine 9 :
|
||
| Toutes les modifications de doses doivent être effectuées par paliers de 28 mg | ||
- Durée du traitement par SPRAVATO
L'arrêt du traitement par SPRAVATO ne nécessite pas de diminution progressive de la dose ; d'après les données issues des essais cliniques, le risque d'apparition de symptômes de sevrage est faible.
- Consignes aux patients, avant l'administRation de SPRAVATO
- se moucher juste avant d'utiliser le premier dispositif (juste avant la première pulvérisation) ;
- ne pas manger pendant au moins 2 heures avant l'administration et ne pas boire de liquides pendant au moins 30 minutes avant l'administration : ces précautions sont prises en raison du risque de nausées et des vomissements observé après la prise de SPRAVATO ;
- ne pas prendre un corticoïde nasal ou un décongestionnant nasal dans l'heure précédant l'administration de SPRAVATO.
- Instructions pour l'utilisation de SPRAVATO
Un dispositif délivre 28 mg d'eskétamine en 2 pulvérisations (1 pulvérisation par narine) :
- 1 dispositif : 28 mg,
- 2 dispositifs : 56 mg,
- 3 dispositifs : 84 mg.
Le dispositif de pulvérisation nasale est composé d'un corps blanc et d'un corps bleu (cf. Figure 1 ci-dessous).
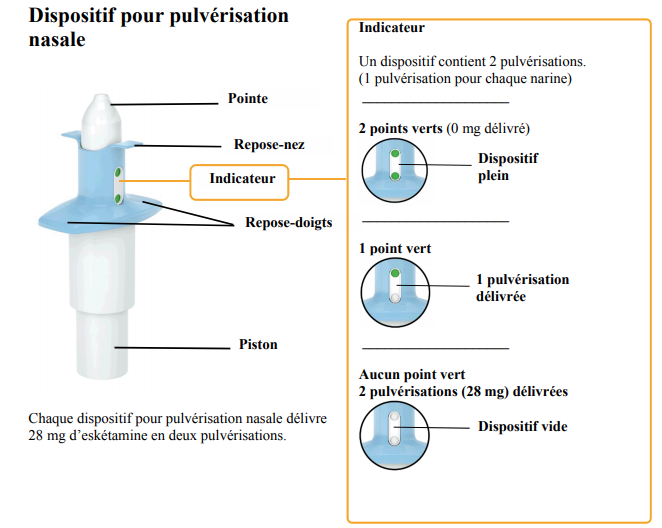
Le corps blanc comprend :
- la pointe (par où est expulsée la solution, dirigée dans la narine) ;
- un indicateur de dose :
- 2 points verts signifient que le dispositif est plein,
- 1 point vert = 1 pulvérisation restante (1 dose délivrée),
- aucun point vert : 2 pulvérisations délivrées = dispositif vide ;
- un piston.
Ce dispositif pour pulvérisation nasale est prêt à l'emploi ; aucun amorçage du dispositif n'est nécessaire :
- incliner la tête vers l'arrière d'environ 45 °,
- appliquer l'embout du dispositif à l'entrée d'une narine, et fermer la narine opposée,
- inspirer par le nez tout en appuyant à fond sur le piston jusqu'à la butée,
- renifler,
- vérifier sur l'indicateur de dose que les points verts ont disparu, et attendre 5 minutes avant la prochaine dose, si nécessaire.
Si 2 ou 3 dispositifs sont nécessaires, il faut respecter une pause de 5 minutes entre l'utilisation de chaque dispositif.
Si un éternuement survient immédiatement après l'administration, aucun nouveau dispositif ne doit être utilisé.
Identité administrative
- Stupéfiant
- Réservé à l'usage hospitalier
- Prescription réservée aux spécialistes et services de psychiatrie
- Prescription limitée à 4 semaines, rédigée en toutes lettres sur ordonnance sécurisée
- Flacon de 0,2 mL avec 1 dispositif pour pulvérisation nasale, CIP 3400955069843
- Agréé aux collectivités (Journal officiel du 1er octobre 2020, texte 43)
- Laboratoire Janssen-Cilag
Pour aller plus loin
Avis de la Commission de la Transparence - SPRAVATO (HAS, 24 juin 2020)
Les études pivot
- Fedgchin M, Trivedi M, Daly EJ, et al. Efficacy and Safety of Fixed-Dose Esketamine Nasal Spray Combined With a New Oral Antidepressant in Treatment-Resistant Depression: Results of a Randomized, Double-Blind, Active-Controlled Study (TRANSFORM-1). Int J Neuropsychopharmacol. 2019 ; 22(10) : 616-630
- Popova V, Daly EJ, Trivedi M et al. Efficacy and Safety of Flexibly Dosed Eskétamine Nasal Spray Combined With a Newly Initiated Oral Antidepressant in Treatment-Resistant Depression: A Randomized Double-Blind Active-Controlled Study. Am J Psychiatry. 2019 ; 176 : 428-38
- Ochs-Ross R, Daly EJ, Zhang Y, et al. Efficacy and Safety of Esketamine Nasal Spray Plus an Oral Antidepressant in Elderly Patients With Treatment-Resistant Depression-TRANSFORM-3. JAMA Psychiatry. 2019. doi: 10.1001/jamapsychiatry.2019.1189
- Daly EJ, Trivedi MH, Janik A et al. Efficacy of Eskétamine Nasal Spray Plus Oral Antidepressant Treatment for Relapse Prevention in Patients With Treatment-Resistant Depression: A Randomized Clinical Trial. JAMA Psychiatry. 2018 ; 75 : 139-48
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Commentaires
Ajouter un commentaire
En cliquant sur "Ajouter un commentaire", vous confirmez être âgé(e) d'au moins 16 ans et avoir lu et accepté les règles et conditions d'utilisation de l'espace participatif "Commentaires" .
Nous vous invitons à signaler tout effet indésirable susceptible d'être dû à un médicament en le déclarant en ligne.
Les plus récents

Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 10 minutes
10 minutes 2 commentaires
2 commentaires .jpg)

.jpg)




Si l'efficacité est à ce point spectaculaire, comment se fait il que les psychiatres ne prescrivent pas ce médicament dans la dépression résistante?
MathieuR: avez vous été hospitalisé?
Vous venez de signaler ce commentaire. Confirmez-vous votre choix?
Pour avoir été traité par Spravato : efficacité rapide et rétablissement spectaculaire, en ce qui me concerne bien sûr cela n'engage que moi.
En revanche, quelques mois après la fin du traitement, l'effet s'estompe et la rechute est très douloureuse.
Il n'est mentionné nulle part la nécessité d'un entretien du traitement sur un plus long terme.