Représentation en 3D de la glucocérébrosidase, enzyme déficitaire dans la maladie de Gaucher (illustration @Wikimedia).
CERDELGA, 1er réducteur de substrat ciblant la partie céramide de la glucosylcéramide synthase
Nouveau médicament de la classe des réducteurs de substrat, CERDELGA 84 mg gélule est indiqué dans le traitement à long terme des patients adultes atteints de la maladie de Gaucher de type 1 (MG1), qui sont métaboliseurs lents (MLs), métaboliseurs intermédiaires (MIs) ou métaboliseurs rapides (MRs) du cytochrome 2D6 (CYP2D6).
Son principe actif, l'éliglustat, est le 1er réducteur de substrat ciblant la partie céramide de la glucosylcéramide synthase dont il est un inhibiteur puissant et spécifique.
En diminuant la synthèse du glucosylcéramide (GL-1), l'éliglustat compense la diminution de son catabolisme chez les patients atteints de la maladie de Gaucher : il empêche ainsi l'accumulation de GL-1 et atténue les manifestations cliniques de cette maladie génétique rare, autosomique récessive, due à une mutation du gène GBA1 (Figure 1).
Figure 1 - Mécanisme d'action de l'éliglustat
(extrait de l'avis de la Commission de la transparence du 21 octobre 2015)
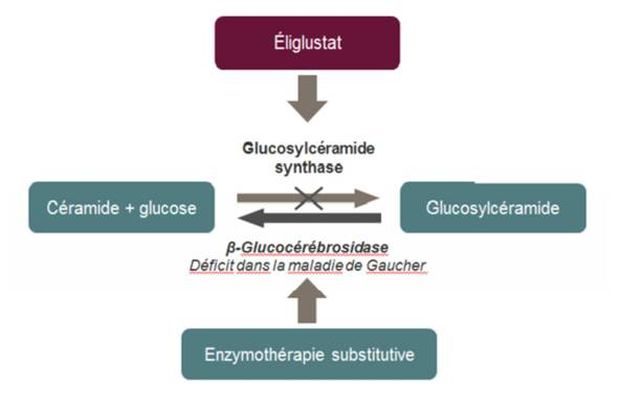
(extrait de l'avis de la Commission de la transparence du 21 octobre 2015)

Médicament orphelin disponible à l'hôpital
CERDELGA est un médicament orphelin qui a fait l'objet d'une autorisation temporaire d'utilisation (ATU) de cohorte de décembre 2014 à mars 2015 ; il a obtenu une autorisation de mise sur le marché (AMM) européenne en février 2015.
Disponible à l'hôpital et agréé aux Collectivités, le traitement par CERDELGA doit être initiée et supervisée par un médecin expérimenté dans la prise en charge de la maladie de Gaucher.
CERDELGA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Etude ENGAGE : CERDELGA supérieur au placebo en termes de réduction du volume splénique
L'efficacité de l'éliglustat a été évaluée dans l'étude de phase III ENGAGE (Mystri, JAMA 2015) randomisée en double aveugle versus placebo, conduite chez 40 patients (20 dans chaque groupe) atteints de la MG1, symptomatiques et naïfs de traitement.
Au terme de 9 mois, 75 % des patients du groupe CERDELGA ont présenté une réduction du volume splénique (critère de jugement principal) supérieur à 20 % par rapport à la valeur initiale, contre 5 % des patients du groupe placebo, soit une différence d'effet entre les deux groupes de 30 % (p < 0,0001).
Une augmentation du taux d'hémoglobine et des plaquettes et une diminution du volume hépatique ont par ailleurs été observées dans le groupe CERDELGA alors ces 3 paramètres se sont détériorés dans le groupe placebo.
Etude ENCORE : l'éliglustat non inférieur au traitement enzymatique substitutif de référence, l'imiglucérase
Une autre étude pivot de phase III, ENCORE (Cox. The Lancet 2015), randomisée, en ouvert, de non infériorité versus l'imiglucérase (CEREZYME), a été conduite chez des patients équilibrés par le traitement enzymatique substitutif de référence.
Au terme d'une année, CERDELGA s'est montré non inférieur à CEREZYME avec un pourcentage de patients ayant atteint le critère principal de jument composite de stabilité hématoviscérale (évolution de l'hémoglobine, des plaquettes, des volumes splénique et hépatique) de 84,8 % dans le groupe CERDELGA (n = 106) et de 93,6 % dans le groupe CEREZYME (n = 53), soit une différence d'effet de 8,8 %.
En termes de tolérance, les effets indésirables les plus fréquents sous éliglustat ont été les arthralgies (15 %) et l'asthénie (14 %) versus, sous imiglucérase, les arthralgies (17 %), une infection des voies respiratoires supérieures (6 %) et une dorsalgie (6 %).
Une alternative par voie orale de manipulation plus délicate que l'enzymothérapie
Dans son avis du 21 octobre 2015, la Commission de la transparence a jugé le service médical rendu (SMR) de CERDELGA important et considéré qu'il représente "une alternative par voie orale à l'enzymothérapie de substitution chez les patients adultes avec maladie de gaucher de type 1".
La Commission indique que, malgré l'avantage de la prise orale de CERDELGA, se pose la question de l'observance de ce traitement chronique au regard des effets secondaires observés dans les études.
Elle précise que "La décision de prescrire CERDELGA doit prendre en compte ses effets indésirables, la question de l'observance du traitement et le manque de recul sur son efficacité au long terme" et que "les nombreuses interactions médicamenteuses liées à son métabolisme rendent la manipulation de CERDELGA plus délicate que celle de l'enzymothérapie".
CERDELGA en pratique : déterminer le statut métaboliseur du CYP2D6
Le génotype CYP2D6 doit être recherché avant d'initier le traitement afin de déterminer le statut métaboliseur du CYP2D6 du patient.
Ce test est réalisé à partir de matériel salivaire ou sanguin, après recueil du consentement du patient.
Ces analyses génétiques sont effectuées en pratique courante dans les laboratoires de pharmacogénétique moléculaire accrédités ou en cours d'accréditation en France.
Les patients suivants ne doivent pas recevoir CERDELGA :
- les métaboliseurs ultrarapides (MURs) ;
- les métaboliseurs indéterminés du CYP2D6 ;
- les patients métaboliseurs intermédiaires (MIs) ou rapides (MRs) du CYP2D6 prenant de façon concomitante :
- un inhibiteur puissant (paroxétine, fluoxétine, quinidine, bupropion) ou modéré (duloxétine, terbinafine) du CYP2D6
- et un inhibiteur puissant (clarithromycine, itraconazole…) ou modéré (érythromycine, fluconazole…) du CYP3A,
- ainsi que chez les métaboliseurs lents (MLs) du CYP2D6 prenant un inhibiteur puissant du CYP3A.
L'administration de CERDELGA avec des inhibiteurs du CYP2D6 ou du CYP3A entraîne une augmentation importante des concentrations plasmatiques d'éliglustat.
A l'inverse, d'autres substances (rifampicine, carbamazépine, phénobarbital, phénytoïne, rifabutine et millepertuis) peuvent diminuer l'exposition à l'éliglustat par induction du CYP3A.
Pas de pamplemousse avec CERDELGA
La consommation de pamplemousse ou de jus de pamplemousse doit être évitée.
Les produits à base de pamplemousse contiennent un ou plusieurs composants qui inhibent le CYP3A et peuvent augmenter les concentrations plasmatiques d'éliglustat.
CERDELGA, une posologie à adapter au statut métaboliseur du CYP2D6
La posologie de CERDELGA est de :
- 84 mg d'éliglustat 2 fois par jour (soit 2 gélules par jour) pour les métaboliseurs intermédiaires (MIs) et les métaboliseurs rapides (MRs) ;
- 84 mg d'éliglustat 1 fois par jour (soit 1 gélule par jour) pour les métaboliseurs lents (MLs) du CYP2D6.
Les gélules peuvent être prises avec ou sans nourriture.
Identité administrative
- Liste I
- Prescription hospitalière
- Boîte de 56, CIP 3400930008782
- Agrément aux collectivités (Journal officiel du 29 décembre 2015 - texte 40)
- Inscription sur la liste de rétrocession (Journal officiel du 29 décembre 2015 - texte 48)
- Prix et conditions de prise en charge à l'étude
- EDIT du 9 novembre 2016 : publication au Journal officiel du 9 novembre 2016 des conditions de prise en charge :
- taux = 100 %,
- périmètre de remboursement : indication de l'AMM ;
- prix UCD de vente aux établissements de santé = 337,200 euros HT (Journal officiel du 9 novembre 2016 - texte 91) / FIN EDIT
- Laboratoire Genzyme
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 21 octobre 2015)
Résumé EPAR à l'intention du public (EMA, mise à jour du 21 avril 2015)
Plan de gestion des risque européen - résumé en anglais (EMA, mise à jour du 21 avril 2015)
Les études pivots
- Mistry PK et al. Effect of Oral Eliglustat on Splenomegaly in Patients With Gaucher Disease Type 1: The ENGAGE Randomized Clinical Trial. JAMA 2015 ; 313 : 695-706
- Cox TM, Drelichman G, Cravo R. Eliglustat compared with imiglucerase in patients with Gaucher's disease type 1 stabilised on enzyme replacement therapy : a phase 3, randomised, open-label, non-inferiority trial. The Lancet 2015 ; 9985 (385) : 2355-62 (abstract)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.