
La réussite du traitement anticoagulant oral nécessite une bonne compréhension et observance
Le laboratoire Merck Serono, en accord avec l'ANSM (Agence nationale de sécurité du médicament et des produits de santé), signale le changement de conditionnement de PREVISCAN 20 mg comprimé quadrisécable (fluindione) depuis le 1er mars 2013.
PREVISCAN se présente désormais en plaquettes prédécoupées permettant l'identification de chaque comprimé grâce à l'inscription, en regard de chaque alvéole du blister, du nom de la spécialité, de la dénomination commune internationale (DCI) et du dosage.
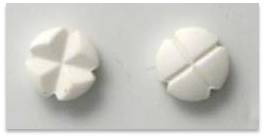 Cette mesure demandée par l'ANSM vise à faciliter et sécuriser la distribution des doses pour le patient en réduisant le risque d'erreur ou de confusion avec d'autres comprimés ayant une forme similaire à ceux de PREVISCAN (comprimé quadrisécable en forme de trèfle, en photo ci-contre). En effet, des erreurs médicamenteuses de cet ordre ont été notifiées lors de l'utilisation de PREVISCAN.
Cette mesure demandée par l'ANSM vise à faciliter et sécuriser la distribution des doses pour le patient en réduisant le risque d'erreur ou de confusion avec d'autres comprimés ayant une forme similaire à ceux de PREVISCAN (comprimé quadrisécable en forme de trèfle, en photo ci-contre). En effet, des erreurs médicamenteuses de cet ordre ont été notifiées lors de l'utilisation de PREVISCAN. En pratique
Au lieu d'un seul blister de 30 comprimés, PREVISCAN est désormais présenté en 2 blisters prédécoupés de 15 comprimés quadrisécables.
Le conditionnement secondaire (étui en carton) n'est pas modifié.
Quelques règles de bon usage à respecter
Les professionnels de santé doivent rappeler aux patients les règles à respecter pour garantir un bon usage des médicaments en général, de PREVISCAN en particulier :
- conserver les médicaments dans leur blister de façon à pouvoir les identifier les comprimés jusqu'au moment de l'administration ;
- lire attentivement l'étiquetage du médicament avant sa prise afin d'éviter tout automatisme lié à la forme du comprimé,
- replacer les éventuelles fractions non utilisées dans leur blister d'origine immédiatement après leur découpe.
D'autres mesures à suivre
L'ANSM et le laboratoire Merck Serono prévoient des mesures complémentaires visant à limiter le risque de confusion avec d'autres comprimés.
Ces mesures sont actuellement en cours de développement.
Pour déclarer les erreurs médicamenteuses
Pour rappel, un dispositif de surveillance des erreurs médicamenteuses est mis à la disposition des professionnels de santé.
Ainsi, tout signalement de risque d'erreur médicamenteuse, d'erreur potentielle ou d'erreur avérée sans effet indésirable , inhérent au(x) médicament(s) peut être transmis directement au Guichet Erreurs Médicamenteuses.
Une fiche de signalement spécifique est disponible sur le site de l'ANSM.
Les erreurs médicamenteuses à l'origine d'un effet indésirable doivent être signalées auprès des centres régionaux de pharmacovigilance.
Pour mémoire :
PREVISCAN est indiqué dans les cas suivants :
- cardiopathies emboligènes : prévention des complications thromboemboliques en rapport avec certains troubles du rythme auriculaire (fibrillations auriculaires, flutter, tachycardie atriale), certaines valvulopathies mitrales, les prothèses valvulaires ;
- prévention des complications thromboemboliques des infarctus du myocarde compliqués : thrombus mural, dysfonction ventriculaire gauche sévère, dyskinésie emboligène..., en relais de l'héparine ;
- traitement des thromboses veineuses profondes et de l'embolie pulmonaire ainsi que la prévention de leurs récidives, en relais de l'héparine.
Sources et ressources complémentaires :
PREVISCAN – Mise à disposition d'un nouveau conditionnement afin de limiter les risques d'erreurs médicamenteuses, ANSM (5 avril 2013)
Lettre du laboratoire aux professionnels de santé (27 mars 2013)
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 2 minutes
2 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.